ОБЗОР МАТЕРИАЛОВ ЭЛЕКТРОННОГО ЖУРНАЛА
«УПРАВЛЕНИЕ КАЧЕСТВОМ В ЗДРАВООХРАНЕНИИ»
№ 12, 2022
Данный выпуск журнала посвящен теме обеспечения качества и безопасности медицинских изделий.
Рубрика - Качество и безопасность медизделий
ЗИНОВЬЕВА Е. Обеспечение безопасности обращения медизделий в медорганизациях: основные термины и порядки
Важную роль в повышении качества медицинской помощи и развитии отечественного здравоохранения играет совершенствование обращения медицинских изделий. Безопасность обращения обеспечивают с двух сторон: и надзорный орган, и поднадзорные ему организации. Росздравнадзор проводит государственный контроль обращения, медицинские организации — внутренний. Автор в своей статье разбирает основные понятия обращения медицинских изделий, рассматривает порядки государственного и внутреннего контроля.
Основные тезисы статьи:
1) Безопасность обращения медизделий в медицинских организациях обеспечивают в двустороннем порядке: надзорный орган — за счет государственного контроля, медорганизации — за счет внутреннего.
2) Государственный контроль включает, в частности, мониторинг безопасности медизделий, в ходе которого медицинские организации сообщают надзорной службе о неблагоприятных событиях, спровоцированных изделиями.
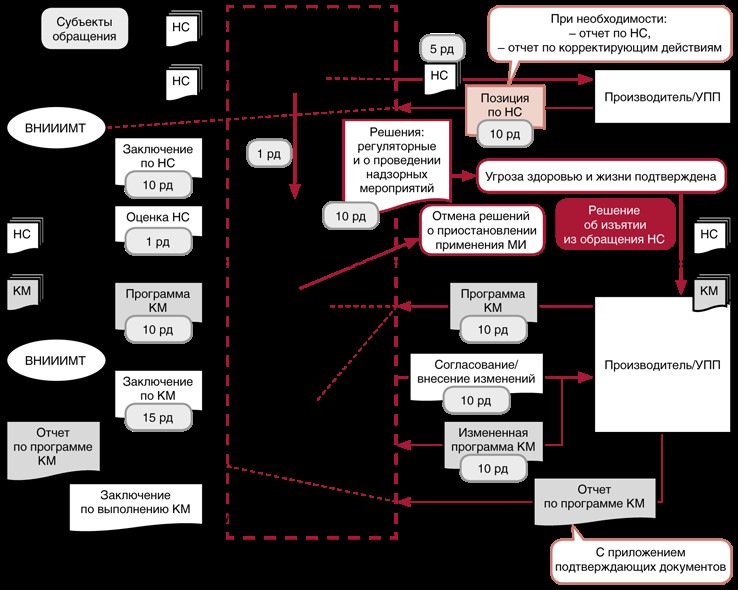
3) В ходе внутреннего контроля медицинские организации оценивают, насколько их работа с медизделиями соответствует требованиям Росздравнадзора. Самооценку он рекомендует проводить по проверочным листам из приказа ведомства от 10.01.2022 № 1.
Чтобы проконтролировать, что правила обращения соблюдают на протяжении всего жизненного цикла изделий — от приема до утилизации, медицинские организации могут использовать таблицу:
Таблица. Управление жизненным циклом медизделия

ИВАНОВ И., ИВАНОВА Т., БОРИСОВА Е. Мониторинг безопасности медизделий: порядок взаимодействия участников
Основные тезисы статьи:
1) Информировать Росздравнадзор о неблагоприятных событиях обязаны все участники мониторинга — и медицинские организации, и производители или их представители.
2) Связь между неблагоприятным событием и применением изделия исследуют обе стороны взаимодействия — и производитель или его представитель, и Росздравнадзор, который для этого привлекает внутреннюю экспертную организацию.
3) Производитель или его представитель обязаны согласовывать свои действия с Росздравнадзором на всех этапах: от сообщения об инциденте и его расследования до публикации уведомления по безопасности изделия, которое составляют после того, как провели корректирующие мероприятия.
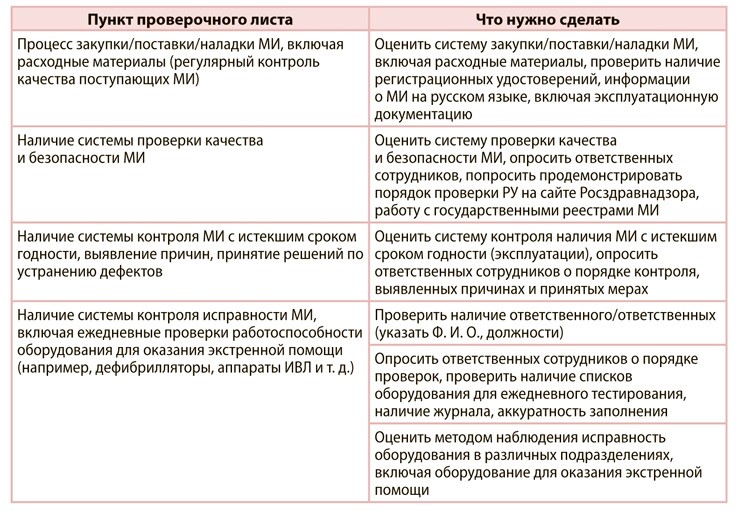
Авторы статьи отобразили схему порядка взаимодействия на рисунке. В верхней части представили порядок оповещения о неблагоприятном событии (НС). В нижней части — порядок обмена информацией о расследовании события и корректирующих мероприятиях (КМ). Сроки указали в рабочих днях (РД).
Рисунок. Порядок взаимодействия участников мониторинга
ИВАНОВ И., ИВАНОВА Т., БОРИСОВА Е. Мониторинг безопасности медизделий: порядок взаимодействия участников
Основные тезисы статьи:
1) Информировать Росздравнадзор о неблагоприятных событиях обязаны все участники мониторинга — и медицинские организации, и производители или их представители.
2) Связь между неблагоприятным событием и применением изделия исследуют обе стороны взаимодействия — и производитель или его представитель, и Росздравнадзор, который для этого привлекает внутреннюю экспертную организацию.
3) Производитель или его представитель обязаны согласовывать свои действия с Росздравнадзором на всех этапах: от сообщения об инциденте и его расследования до публикации уведомления по безопасности изделия, которое составляют после того, как провели корректирующие мероприятия.
Авторы статьи отобразили схему порядка взаимодействия на рисунке. В верхней части представили порядок оповещения о неблагоприятном событии (НС). В нижней части — порядок обмена информацией о расследовании события и корректирующих мероприятиях (КМ). Сроки указали в рабочих днях (РД).
Рисунок. Порядок взаимодействия участников мониторинга
Медорганизации сообщают о событии и производителю, и Росздравнадзору
ИВАНОВ И., ИВАНОВА Т., БОРИСОВА Е. Регистры пациентов в системе мониторинга безопасности, качества и эффективности медизделий. Опыт ВНИИИМТ Росздравнадзора
Медицинские изделия проверяют, соответствуют ли они техническим требованиям, поскольку это влияет на их клиническую эффективность и безопасность применения. Но некоторые проблемы медизделий, которые могут навредить здоровью и жизни граждан, нельзя предвидеть на этапе производства и в ходе испытаний для государственной регистрации. Их обнаруживают спустя время, по мере того как накапливают клинический опыт применения. Авторы в своей статье разбирают, как работает система пострегистрационного наблюдения, и рассматривают пилотный проект регистра, который в 2021 году запустили Росздравнадзор и Всероссийский научно-исследовательский и испытательный институт медицинской техники Росздравнадзора. Особое внимание уделили мониторингу в области заболеваний сердечно-сосудистой системы и коронарным стентам.
Основные тезисы статьи:
1) Безопасность, клиническую эффективность и технические характеристики медизделий нужно оценивать совместно.
2) В зарубежной практике регистры — потенциальный инструмент для клинического мониторинга отдаленных последствий, которые могут возникнуть после имплантации медизделий.
3) С помощью мониторинга безопасности, качества и клинической эффективности можно предотвратить инциденты и последствия, которые могут возникнуть у пациента из-за медизделия.
4) Систему «Регистр пациентов с имплантированными медицинскими изделиями» нужно масштабировать и наполнять данными наблюдения за пациентами, чтобы действенно оценивать безопасность и эффективность медизделий.
ЩЕБЛЫКИНА А., МАМЛЕНКОВА Е., АВЕРЬЯНОВА Е. и др. Распространенные ошибки в работе с медизделиями и решения от регулятора и практиков
В статье авторы - специалисты из Национального института качества Росздравнадзора проанализировали ошибки, которые клиники часто допускают при обращении медицинских изделий. Список составили по результатам более чем 200 аудитов по требованиям из раздела «Контроль качества и безопасности обращения медицинских изделий» Практических рекомендаций для стационаров. Специалисты объяснили, что приводит к нарушениям и как это исправить. Рекомендовали успешные комплексные решения от практиков.
Основные тезисы статьи:
1) Национальный институт качества Росздравнадзора провел больше 200 аудитов по обращению медизделий и установил, что общий уровень соблюдения требований ниже, чем тот, при котором организацию признают безопасной.
2) Лучше всего клиники соблюдают условия хранения и требования к упаковке и маркировке медизделий, а также требования к обучению пациентов безопасной эксплуатации приборов. Хуже всего следуют рекомендациям к организации контроля качества и безопасности обращения и обеспечению работы этой системы.
3) Результаты аудитов, опыт внедрения медорганизаций, наиболее частые вопросы клиник учли во второй версии Практических рекомендаций по ВКК и БМД для стационаров.
4) Эксперты Национального института качества Росздравнадзора рассказали о лучших практиках, которые оптимизировали работу с медизделиями в пензенской «Клинической больнице № 6 им. Г.А. Захарьина» и в московской сети клиник «Медси».
Видеостатья. Как ранжировать нежелательные события в зависимости от последствий
Редакция журнала разместила видеоразъяснения Игоря Иванова, генерального директора ФГБУ «ВНИИИМТ» Росздравнадзора, как ранжировать нежелательные события в зависимости от последствий.
Рубрика - Внешние проверки
ГРОЗДОВА Т. Как по-новому отчитываться о покупке и ремонте оборудования. Образцы для руководителей
ФФОМС обновит правила составления и подачи отчета о мероприятиях, которые медицинские организации проводят за счет фонда. Напомним: с 2016 года на средства нормированного страхового запаса медицинская организация может дополнительно купить или отремонтировать оборудование. Для этого она подает заявку в Департамент здравоохранения, который может включить покупку или ремонт оборудования в квартальный план мероприятий и оплатить.
В статье – что представляет собой новая форма отчета, как и когда его подавать.
Основные тезисы статьи:
1) По проекту приказа ТФОМС* медорганизации будут ежемесячно отчитываться о том, как они распорядились средствами фонда.
2) Срок подачи отчета перенесут на 10 дней вперед.
3) Составлять отчет нужно с нарастающим итогом и подавать его в ГИС ОМС.
Скринкаст. Какие документы по организации ВКК и БМД проверит Росздравнадзор.
Сотрудники редакции журнала предлагают скринкаст, какие документы по организации внутреннего контроля качества и безопасности медицинской деятельности необходимо подготовить медицинской организации к визиту инспектора Росздравнадзора.
Рубрика - Ассортимент гемостатических средств
МОМЫНАЛИЕВ К., КУХАРЕНКО М., ИВАНОВ И. Как лечить тяжелые кровотечения в военных условиях и на догоспитальном этапе. Обзор гемостатических средств
Авторы статьи предлагают обзор гемостатических средств, принципов их работы и результатов исследований
Основные тезисы статьи:
1) Различные кровоостанавливающие средства разрабатывают, чтобы лечить тяжелые кровотечения в военных условиях и на догоспитальном этапе.
2) Гемостатические продукты на основе хитозана могут уменьшать и останавливать массивные кровотечения в догоспитальных условиях.
3) Новые гемостатические технологии и биоматериалы нужны не только для неотложных сценариев в гражданских и военных условиях, но и для различных терапевтических вмешательств.
Ознакомиться с полным оглавлением выпуска журнала можно на сайте e.uprzdrav.ru.
Для получения текста заинтересовавшей статьи, а также образцов рабочих инструментариев медсестер слушатели могут обратиться в библиотеку ГООАУ ДПО «МОЦПК СЗ», направив запрос - заявку на электронную почту mocpk_lib@mail.ru. Заявка составляется в произвольной форме, с обязательным указанием ФИО слушателя и номера цикла, на котором проходит обучение. Моб. т. + 7 900 936 16 03.